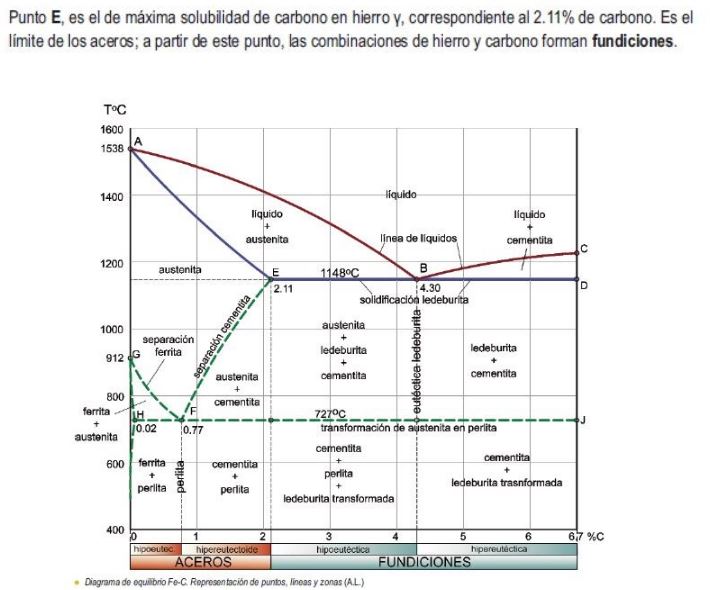
Egoera solidoan dauden materialak hainbat fasez osatuta egon daitezke. Fase horien konbinazioak materialak izango dituen propietate asko definitzen ditu. Horregatik, beharrezkoa da tresna teoriko bat izatea, materialean egongo diren faseak deskribatu ahal izateko. Tresna teoriko horri fase-diagrama deitzen zaio.
Material baten fase solidoek honako ezaugarri hauek dituzte:
• Fasea osatzen duten atomoek egitura edo konponketa atomiko bera dute.
• Faseak konposizio kimiko bera du bolumen osoan.
• Propietate fisiko berberak ditu.
• Ingurunearekin zehaztutako interfasea du.
Material puruek fase bakarra dute. Aleazioek aldi berean bi fase edo gehiago izan ditzakete. Aleazioa egoera solidoan dagoen soluzio gisa definitzen da. Soluzio bat bi elementu kimiko edo gehiago nahastea baino ez da. Faseen diagrama bat material batean dauden faseak deskribatzen dituen “mapa” bat da, aldagai termodinamikoen arabera.
Aleazio bat osatzeko bi elementu edo gehiago nahasten direnean, honako egoera hauek gerta daitezke:
- Disolbagarritasun mugagabea dago, eta fase solido bat sortzen da. Kasu honen adibide tipikoa ura eta alkohola nahasten direnean izaten da. Bi metalen kasuan, kobreak eta nikelak disolbagarritasun mugagabea dute, eta fase bakar bat sortzen da egoera solidoan.
- Disolbagarritasuna mugatua da, eta horrek esan nahi du osagaietako bat muga jakin batera arte disolba daitekeela bestean. Kasu horretan bi fase edo gehiago gertatzen dira konponbidean. Gatza urarekin nahastea da ohiko adibidea. Kantitate batzuetan, gatza uretan erabat disolbatzen da, fase bat sortuz (ur gazia). Muga jakin baten ondoren, gatza ez da gehiago disolbatzen, eta bi fase sortzen dira (ur gazia + disolbatu gabeko gatza). Metalen kasuan, kobreak eta zinkak disolbagarritasun mugatua dute, eta hainbat fase sortzen dira egoera solidoan.
Aurtengo ikasturtean, fase bitarreko diagramak aztertuko dituzte. Aleazio bitar bat bi osagairen nahasketaz bakarrik osatuta dago. Nahastean osagai bakoitzak duen kantitatea pisuaren ehunekoaren arabera kuantifikatzen da. Demagun aleazio bat fabrikatzen dela a osagaia b osagaiarekin nahastuz, pisuaren ehunekoak honako hauek izango dira:
A-REN pisuaren ehunekoa= 100 * A masa/ (A masa + B masa)
B-REN pisuaren ehunekoa=100* B masa/ (A masa+ B masa)
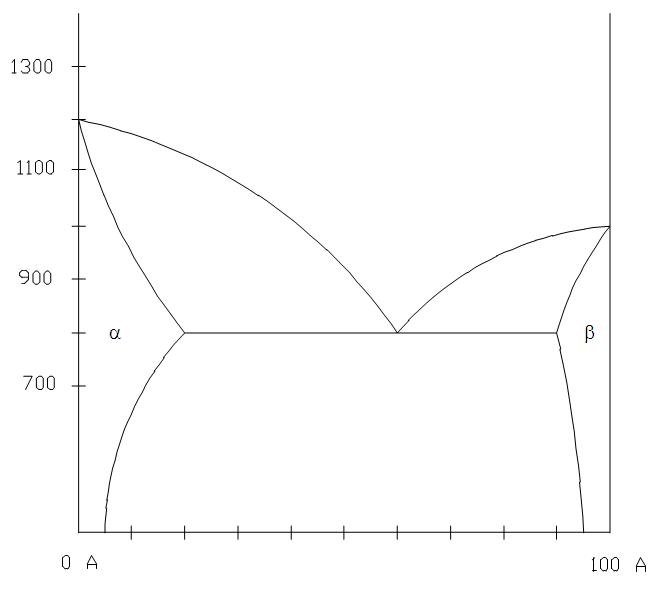
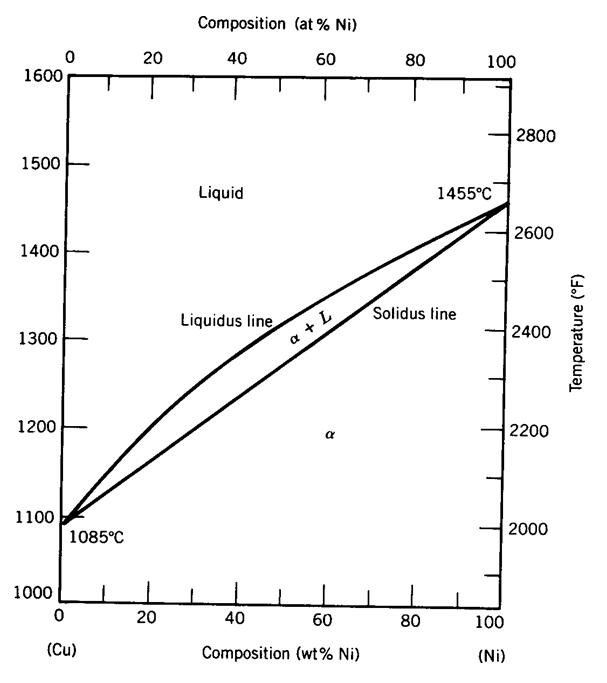
Fase-diagrama grafiko bat da, ardatz bertikalean tenperatura neurtzen duena eta ardatz horizontalean aleazioa osatzen duten osagaien pisuaren ehunekoa neurtzen duena. Jarraian, Cobre-Nicel aleazioaren fase-diagrama erakusten da.
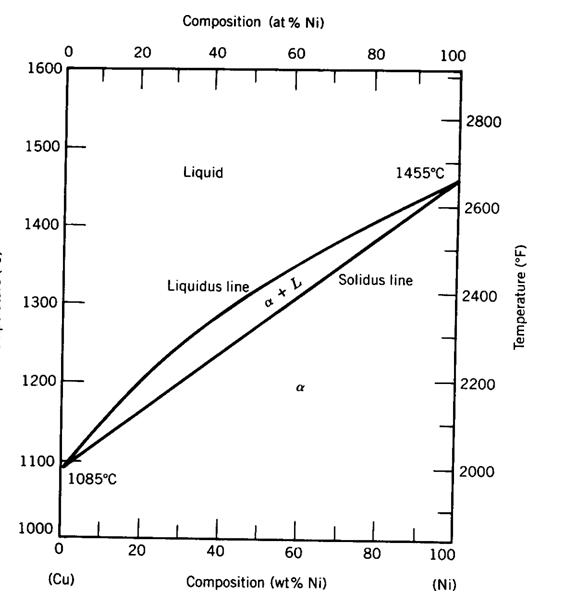
Faseen diagramak honako informazio hau lortzeko aukera ematen du:
- Aleazioan dauden faseak, tenperaturaren eta konposizio kimikoaren arabera. Cobre-nikel aleazio bat 1300º C-ko tenperaturan badago, aleazioa% 20 Ni eta% 80 Cu dela esan nahi du. Diagraman lerro horizontal bat trazatzen da 1300ºC-tan eta ondoren lerro bertikal bat% 20 Ni-tan. Bi lerro hauek gurutzatzen diren puntuak aleazioa irudikatzen du. Puntua kokatuta dagoen gunearen izenak fasearen edo faseen izena ematen digu.
Adibide honetarako, aleazioa fase likidoan dago tenperatura eta konposizio kimiko horretan.
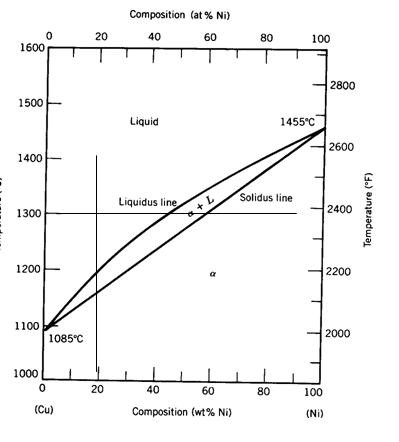
2. Egungo faseen konposizio kimikoa. Hemen bi kasu daude:
• Aleazioak fase bat badu, fasearen konposizioa aleazioaren konposizioaren berdina da.
• Aleazioak bi fase baditu, horietako bakoitzaren osaera diagraman agertzen denaren araberakoa izango da.
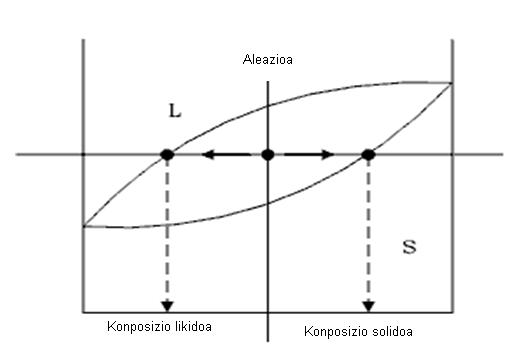
3. Fase bakoitzaren kantitatea, zatikitan edo ehunekotan, aleazioaren masa osoarekiko. Horretarako palankaren erregela erabiltzen da..
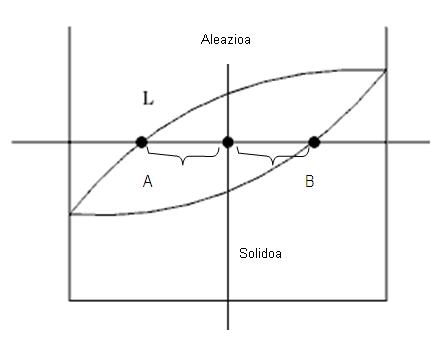
Likido portzentaia = 100 * B distantzia / (A+B distantzia guztira)
Solido portzentaia = 100 * A distantzia / (A+B distantzia guztira)
Aleazioak solidotzean, bereizketa gertatzen da. Fenomeno honen arabera, lehenik sortzen den solidoaren konposizio kimikoa eta azkenik sortzen den solidoarena desberdinak dira. Hori faseen diagramaren ondorioa da.
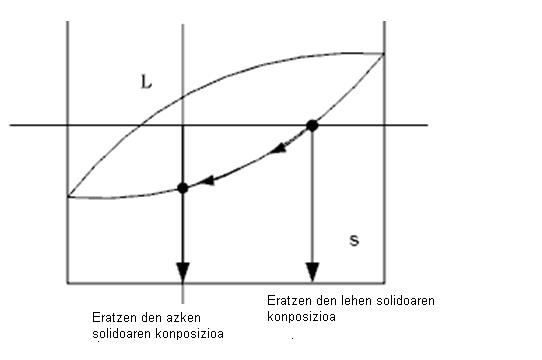
Segregazioak pieza solidoaren konposizio kimikoa uniformea ez izatea eragiten du. Uniformetasun falta horrek piezaren propietate mekanikoek ere ez dute eragiten
Uniformeak izan. Zenbait aplikaziotarako, propietate mekanikoetan uniformetasun falta hori eragozpena izan daiteke.
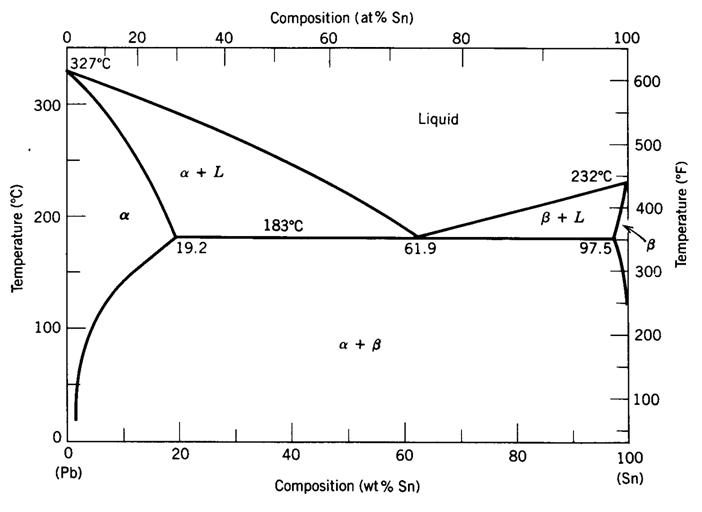
Disolbagarritasuna mugatua denean, faseen diagrama desberdina da. Jarraian, eztainu eta berunezko aleazio baten faseen diagrama erakusten da.
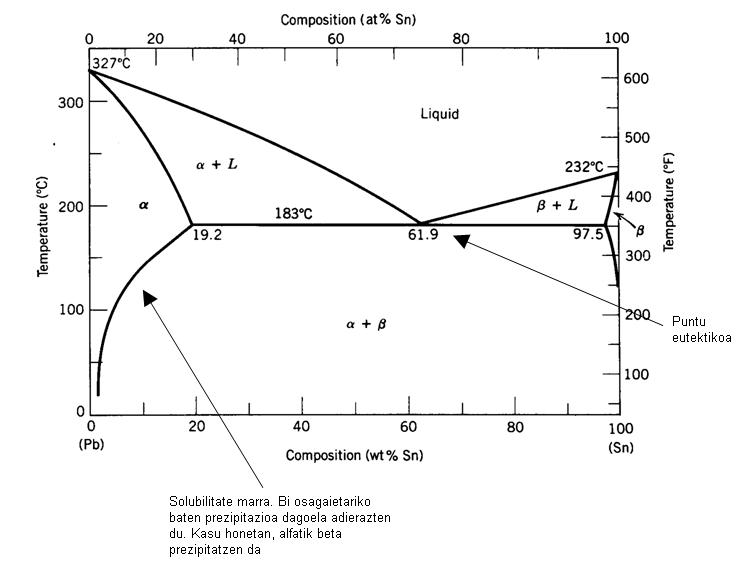
Diagrama honek bi ezberdintasun esanguratsu ditu aurrekoarekiko:
- Disolbagarritasun-lerroak ditu. Lerro horiek adierazten dute osagai batek beste batetik prezipitatzen duenean, neurrira egindako ur gaziko disoluzio baten gatza prezipitatzen duenaren antzera, hoztu egiten dela.
- Puntu eutektiko bat du. Puntu honetan likido guztia berehala solido bihurtzen da. Solidotzea azkarra denez, ez da nukleazio eta hazkuntzatzat hartzen, eta, beraz, sortzen den solidoak egitura ezberdina du. Solido horri solido eutektikoa deitzen zaio. Solido eutektikoa beti tenperatura berean eratzen da, tenperatura eutektikoa deitzen zaiona.
Disolbagarritasuna mugatua duen aleazio bitar baten solidotzea honela gerta daiteke:
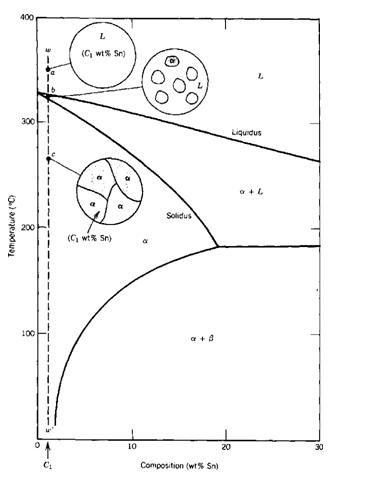
Ez dago prezipitaziorik, ezta eutektikorik ere. Aleazio solidoa disolbagarritasun mugagabea duen aleazio baten berdina da. Prozesuaren amaieran fase sendoa dago
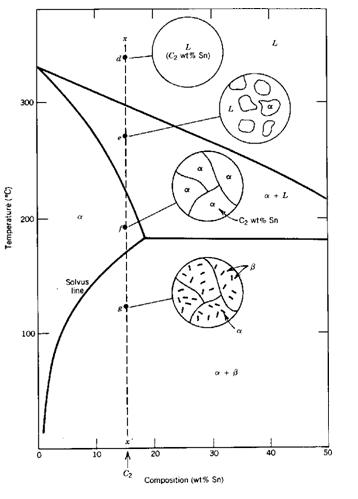
Hoztean, aleazioa disolbagarritasun-lerro batetik igarotzen da, eta osagai baten prezipitazioa sortzen da. Alfa fase solidoaren adibiderako, solido-partikula txikiak prezipitatzen dituzte.
Beta. Alfa eta beta solidoak dira, beren konposizio kimikoagatik ezberdinak.
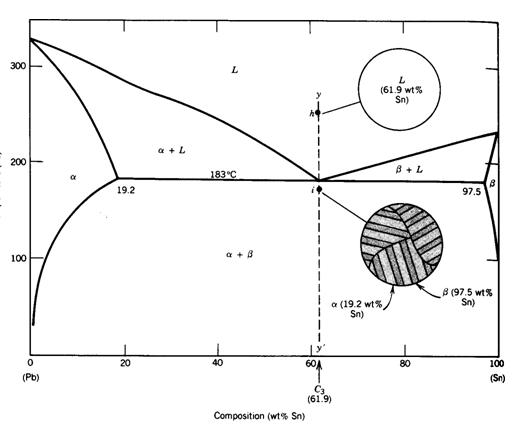
Aleazioak konposizio eutektikoa du. Tenperatura eutektikotik gora (183ºC adibiderako) aleazio guztia erabat likidoa da. Tenperatura horretatik behera, dena da solido eutektikoa.
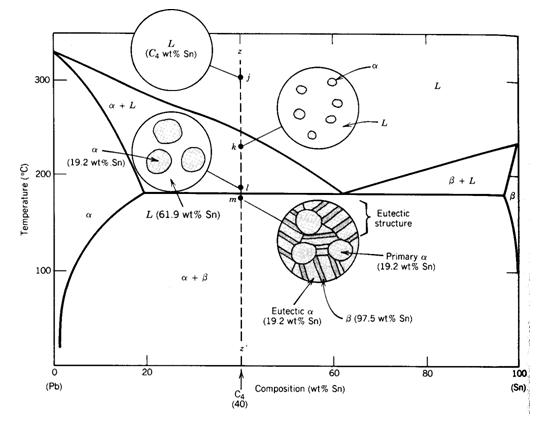
Aleazioak bi fase solido ditu. Faseetako bat (alfa kasu honetan) tenperatura eutektikotik gora eratzen da. Horregatik deitzen zaio alfa proeutektikoa. Beste fasea eutektiko solidoa da.
Kasu horietako bakoitzerako, giro-tenperaturan dagoen solidoaren mikroegitura desberdina da (alfa solidoa, alfa solidoa + beta prezipitatua, solido eutektikoa, alfa solidoa + solido eutektikoa). Gainera, puntu eutektikoaren eskuinaldean, solido beta + solido eutektikoa, solido beta + alfa prezipitatua eta solido beta eratzen dira.
Faseen konbinazio sorta honen ondorioz, aleazio bakoitzaren propietateak ezberdinak dira. Ondorioa da bi metal kantitate ezberdinetan nahasteak aleazio ezberdinak sortzen dituela, zeinek propietate ezberdinak dituzten euren artean. Honek, Materialen Zientziaren ideia nagusietako bat baliozkotzen du: material baten propietateak, bere egituraren araberakoak dira.
ARIKETAK
Ariketa piloa ebatzita hemen
(1)
Kobrezko eta zinkezko aleazio baten konposizio kimikoa ezezaguna da. Hala ere, 500º C-ko tenperaturan % 35eko “y” fasean dago beta faseko ehuneko ezezagunarekin nahastuta.
(A) Beta fasearen zer ehuneko dago aleazioan?
(B) aleazioaren konposizio kimikoa aurkitzen du.
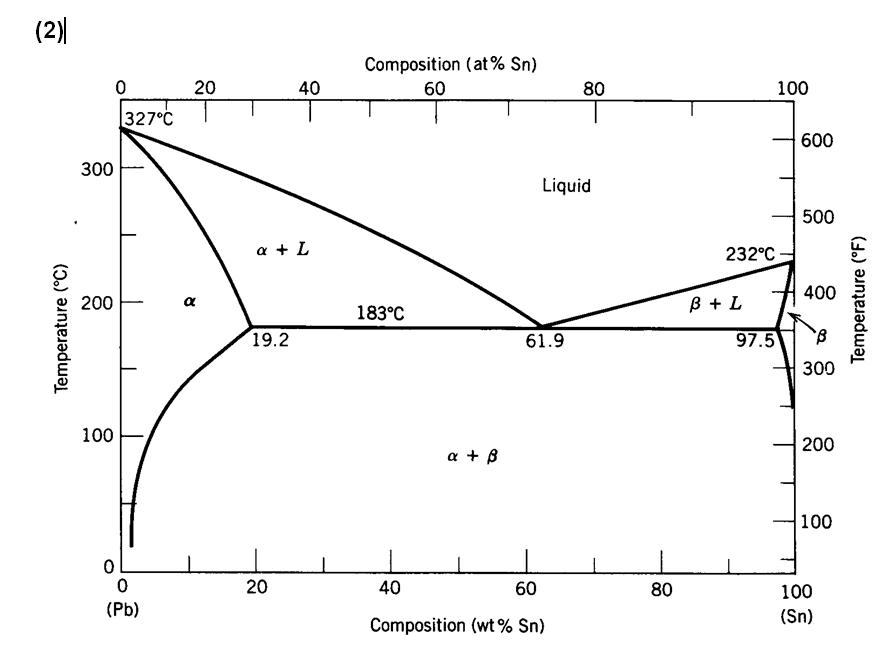
Irudian beruna (Pb) eztainua (Sn) faseen diagrama erakusten da. 400 gramo aleazio fabrikatu nahi dira, baldin eta 183 C-tan% 20 alfa fasea badu eta% 80 solido eutektikoa. Zenbat gramo eztainu eta zenbat gramo berun nahastu behar dira aleazio hori lortzeko?
(3) Zenbat gramo a metal gehitu behar zaizkio 500 gramo B metalari,% 50eko aleazioa sortzeko alfa pisuan 900º C-tan?
(4) Pb-Sn aleazio batek% 25 alfa eta% 75 beta ditu 100º C-tan, aleazioaren konposizioa zehazteko. Aleazio hipoeutektikoa ala hipereutektikoa da?
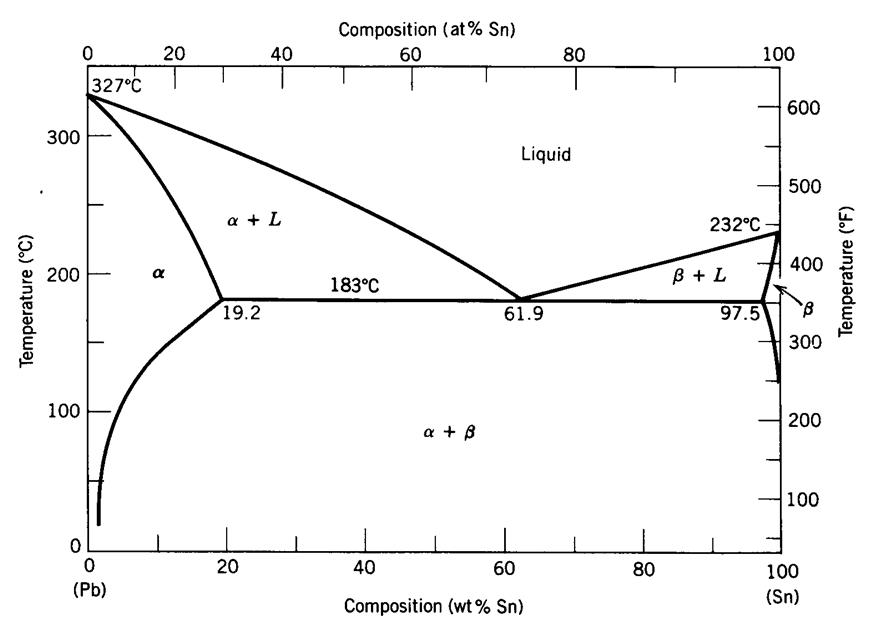
(5) Erakutsitako fase-diagramak aleazio eztainu (Sn) – Berun (Pb) bat deskribatzen du. 183.1 C-ko tenperaturan aleazioa beta fase solidoko %32 inguruz osatua dagoela ikus daiteke. Zehaztu aleazioaren eztainuaren ehunekoa.
(6) Cu-% 20ko aleazioa duen 1200 lb-ko bainu bat, Ni-ren pisuan, 1300º C-tan mantentzen bada. Zenbat nikel libera gehi dakioke bainu honi solido bat sortu aurretik? Zenbat kobre libera gehitu behar dira bainu osoa solidoa izan dadin?
Selektibitateko ariketa
Jatorrizko dokumentua: http://www.uca.edu.sv/facultad/clases/ing/m210031/Tema%2006.pdf




